血管内流动的血液对血管侧壁的压强,即单位面积上的压力,称为血压(blood pressure)。按照国际标准计量单位规定,血压的单位是帕(Pa)或千帕(kPa),习惯上常以毫米汞柱(mmHg)表示,1mmHg=0.1333kPa。通常所说的血压是指动脉血压。大静脉压和心房压较低,常以厘米水柱(cmH2O)为单位,1cmH2O=0.098kPa。

血压的概念
动脉血压是人体的基本生命体征之一,也是临床医生评估患者的病情轻重和危急程度的主要指标之一。动脉血压测量的方法主要有两种:直接测量法和间接测量法。目前临床上常用的是无创、简便的间接测量法(Korotkoff音法)。由于大动脉中的血压落差很小,故通常将上臂测得的肢动脉血压代表动脉血压。
直接测量法
动物实验中测量血压的经典方法。将导管的一端插入动脉,另一端连接一个装有水银的U形管,其两边水银面的高度差即为该测定部位的血压值。由于水银柱的惯性较大,不能很好反映动脉血压的动态变化,故目前多采用压力换能器连接导管,将压强能的变化转变为电能的变化。此法能精确测出心动周期中每一瞬间的血压数值,但因具有一定创伤性,且操作技术要求也较高,故在临床上难以普及推广。

动物实验中直接测量血压的方法
间接测量法
测量时被测者一般取坐位或平卧位,上臂的中点与心脏保持同一水平位。测量者通过扪诊(触及动脉搏动)定位肱动脉,将血压计袖带以适当松紧度缠绕于被测者上臂,袖带下缘位于肘弯横纹上方2~3cm处。听诊器膜型体件置于肘窝部、肱二头肌腱内侧的肱动脉搏动处。然后,向袖带的气囊内充气加压,当所加压力高于收缩压时,该处的肱动脉血流被完全阻断,肱动脉搏动消失,此时在听诊器上听不到任何声音。继续充气使汞柱再升高20~30mmHg,随后以每秒2~3mmHg的速度缓慢放气,当袖带内压力稍低于收缩压的瞬间,血流突入被压迫阻塞的血管段,形成湍流撞击血管壁,此时听到的第一次声响(Korotkoff音)的血压计汞柱读数即为收缩压。当袖带内压力降到等于或稍低于舒张压时,血流完全恢复畅通,听诊音消失,此时的汞柱读数为舒张压。用Korotkoff音听诊法测得的动脉收缩压和舒张压与直接测量法相比,相差不足10%。
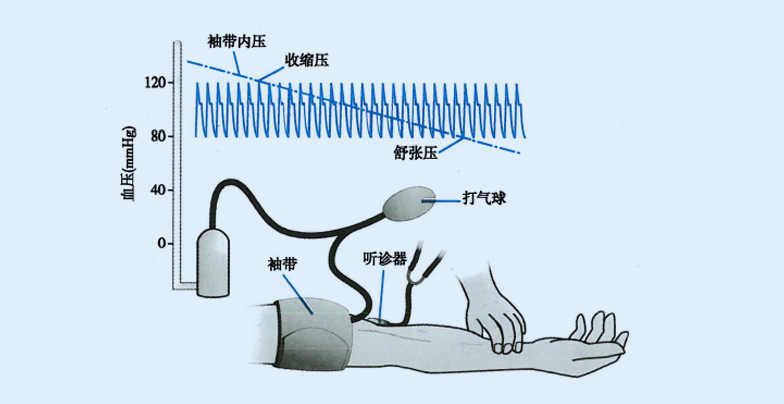
Korotkoff音听诊法
动脉血压可用收缩压、舒张压、脉压和平均动脉压等数值来表示。在安静状态下,我国健康青年人的收缩压为100~120mmHg,舒张压为60~80mmHg,脉压为30~40mmHg。动脉血压存在个体、年龄和性别差异。随着年龄的增长,血压呈逐渐升高的趋势,且收缩压升高比舒张压升高更为显著。女性的血压在更年期前略低于同龄男性,而更年期后则与同龄男性基本相同,甚至略有超越。通常情况下,正常人双侧上臂的动脉血压也存在左高右低的特点,其差异可达5~10mmHg。
此外,正常人血压还存在昼夜波动的日节律。大多数人的血压在凌晨2~3时最低,上午6~10时及下午4~8时各有一个高峰,从晚上8时起呈缓慢下降趋势,表现为“双峰双谷”的现象。这种现象在老年人和高血压患者中更为显著。根据血压的昼夜波动规律,临床上偶测血压应选择高峰时为宜,这对于制订高血压患者的给药方案有一定的指导意义。但在发病时间较长的高血压患者,这种血压的日节律减弱甚至消失,这可能与血管平滑肌的增生有关,并对高血压患者并发症的发生及其预后产生影响。

平均动脉血压昼夜变化的图示
在生理情况下,动脉血压的变化是多种因素综合作用的结果。为了便于理解和讨论,在下面单独分析某一影响因素时,都假定其他因素恒定不变。
心脏每搏输出量
每搏输出量的改变主要影响收缩压。通常情况下,收缩压的高低主要反映每搏输出量的多少。
心率

心率的变化主要影响舒张压。心率加快时,心室舒张期明显缩短,因此在心舒期从大动脉流向外周的血量减少,存留在主动脉内的血量增多,致使舒张压明显升高。由于舒张期末主动脉内存留的血量增多,致使心缩期主动脉内血量增多,收缩压也相应升高,但由于血压升高使血流速度加快,在心缩期有较多的血液流向外周,使收缩压升高程度较小,故脉压减小。同理,当心率减慢时,舒张压下降较收缩压下降更显著,因而脉压增大。
外周阻力
外周阻力以影响舒张压为主。外周阻力增大时,心舒期内血液外流的速度减慢,因而舒张压明显升高。在心缩期,动脉血压升高使得血流速度加快,因而收缩压升高不如舒张压升高明显,故脉压减小。当外周阻力减小时,舒张压和收缩压都减小,但舒张压降低更显著,故脉压加大。通常情况下,舒张压的高低主要反映外周阻力的大小。
主动脉和大动脉的弹性贮器作用
弹性贮器作用主要使心动周期中动脉血压的波动幅度减小。老年人由于动脉管壁硬化,管壁弹性纤维减少而胶原纤维增多,导致血管可扩张性降低,大动脉的弹性贮器作用减弱,对血压的缓冲作用减弱,因而收缩压增高而舒张压降低,结果使脉压明显加大。
循环血量与血管系统容量的匹配情况
生理情况下,循环血量与血管系统容量是相匹配的,即循环血量略多于血管系统容量,使之产生一定的循环系统平均充盈压,这是血压形成的重要前提。大失血后,循环血量减少,此时如果血管系统容量变化不大,则体循环平均充盈压将降低,动脉血压便下降。如果血管系统容量明显增大而循环血量不变,也将导致动脉血压下降。
高血压(hypertension)是以体循环动脉压增高为主要表现的临床综合征,为最常见的心血管疾病,可分为原发性高血压和继发性高血压(又称高血压病)。
1998年WHO和世界高血压联盟(ISH)重新修订的高血压诊断标准为:收缩压≥140mmHg或舒张压≥90mmHg。我国高血压诊断标准自1959年确定至今,已修订4次,目前与1998年的国际标准一致。而目前对低血压的定义尚无统一标准,一般把收缩压低于90mmHg或舒张压低于60mmHg划定为低血压。
血压持久升高可引起心、脑、肾、血管等器官的继发性病变。当血压增高时,外周血管阻力升高,心室压力负荷(后负荷)加重。根据流行病学研究标准判断,血压升高是脑卒中和冠心病发病的独立危险因素。长期高血压将导致心肌肥厚和动脉硬化,最终可发展为心力衰竭,而脑动脉硬化时则易引发脑血管意外,如脑栓塞、脑出血等
注:当SBP和DBP分属于不同级别时,以较高的分级为准。
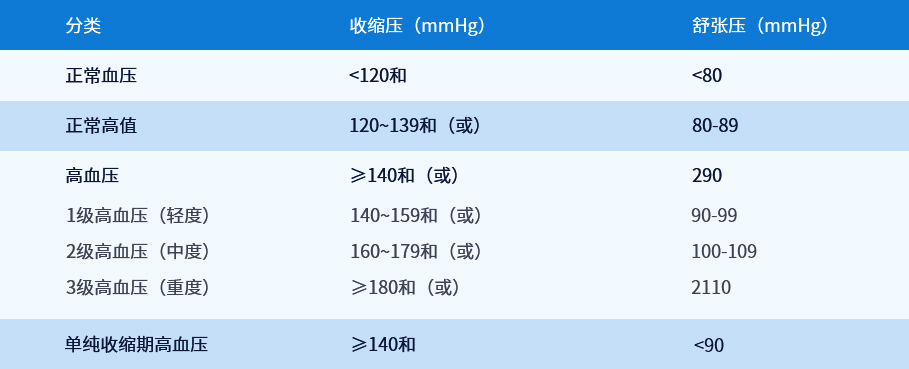
高血压诊断标准
抗高血压药物作用于影响血压的各个环节,根据其作用环节的不同,可分为以下几类∶
利尿药
-
噻嗪类利尿药,如氢氯噻嗪等。

-
祥利尿药,如味塞米等。

-
保钾利尿药,如螺内酯等。
肾素-血管紧张素-醛固酮系统抑制药
-
血管紧张素转化酶抑制药,如卡托普利、依那普利等。

-
血管紧张素Ⅱ受体阻断药,如氯沙坦、缬沙坦等。

-
肾素抑制药,如阿利吉仑。

-
醛固酮拮抗药,如螺内酯等。
钙通道阻滞药
如硝苯地平、氨氯地平等。
交感神经抑制药
-
中枢性降压药,如可乐定等。

-
神经节阻断药,如美卡拉明等。

-
去甲肾上腺素能神经末梢阻滞药,如利血平等。

-
肾上腺素受体阻断药,如普萘洛尔、特拉唑嗪等。

血管扩张药
如硝普钠、肼屈嗪等。
-
利尿药
利尿药是治疗高血压的基础药物,可以减少细胞外液的量及心输出量,起到降压的作用。临床降压以噻嗪类利尿药为主,其中氢氯噻嗪最为常用。袢利尿药用于高血压伴心功能不全和(或)肾衰竭者,低效利尿药一般与中高效利尿药合用以增强疗效并防止低血钾。

氢氯噻嗪(hydrochlorothiazide):降压作用温和,持久,多数病人用药2~4周内出现血压下降。初期降压是通过排钠利尿,减少细胞外液和血容量,导致心输出量减少而降低血压;长期降压可能是通过排钠降低平滑肌细胞内Na+浓度,使Na+-Ca2+交换降低,细胞内Ca2+浓度降低,从而使血管平滑肌对去甲肾上腺素等缩血管物质的反应性减弱,血管平滑肌舒张,血压下降。单用适用于轻度高血压。与其他降压药联合治疗中、重度高血压。长期大量使用噻嗪类利尿药可引起电解质代谢紊乱、脂质代谢紊乱、糖耐量降低。
保钾利尿药螺内酯(spironolactone)作用温和,适用于低血钾症、高尿酸血症或原发性醛固酮增多症的病人。高效利尿药如呋塞米(furosemide)适用于高血压危象及伴有氮质血症或尿毒症的高血压患者。吲哒帕胺(indapamide)不引起血脂改变,伴有高脂血症的患者可用其代替噻嗪类利尿药。
-
肾素-血管紧张素-醛固酮系统抑制药
血管紧张素转化酶抑制药
血管紧张素转化酶抑制药(angiotensin-converting enzyme inhibitor,ACEI)不仅能有效降压,还具有多器官保护作用,对血脂和血糖代谢无不良影响,并能防止和逆转心血管重塑。临床常用的有卡托普利、依那普利、西拉普利、贝那普利等。具有中等强度的降压作用,可增加肾血流量,并且不引起反射性心率加快。
ACEI降压机制主要为:
- 抑制ACE活性,使AngⅡ生成减少,血管扩张,血压下降;
- 抑制血管ACE活性,减轻血管平滑肌细胞增生,有助于逆转血管重构;
- 减少醛固酮的分泌,减少水钠潴留,血容量减少,血压降低;
- 抑制缓激肽的降解,促进NO和前列腺素释放,血管扩张,降低血压;
- 抑制交感神经系统活性,降低外周血管阻力。
ACEI适用于各型高血压。对伴有糖尿病、胰岛素抵抗、左心室肥厚、心力衰竭、急性心肌梗死的高血压患者效果尤佳。主要的不良反应有顽固性无痰干咳、高血钾等。
血管紧张素Ⅱ受体阻断药
AngⅡ受体分两型,即ATl受体和AT2受体。血管紧张素Ⅱ受体阻断药(angiotensinⅡ receptor blockers,ARB)主要为ATl受体阻断剂。
 ARB阻断AngⅡ的效应强于ACEI,且不良反应少于ACEI。目前临床上应用的AT1受体阻断药可分为:二苯四咪唑类,如氯沙坦(losartan)、厄贝沙坦(irbesartan);非二苯四咪唑类,如替米沙坦(telmisartan);非杂环类,如缬沙坦(valsartan)。
ARB阻断AngⅡ的效应强于ACEI,且不良反应少于ACEI。目前临床上应用的AT1受体阻断药可分为:二苯四咪唑类,如氯沙坦(losartan)、厄贝沙坦(irbesartan);非二苯四咪唑类,如替米沙坦(telmisartan);非杂环类,如缬沙坦(valsartan)。氯沙坦是第一个用于临床的非肽类ARB。用于轻、中度高血压。对伴有糖尿病、肾病和慢性心功能不全患者有良好疗效。与利尿药或钙通道阻滞药合用,可增强降压疗效。不良反应较少,少数患者可出现眩晕。
肾素抑制药

抑制肾素活性,可以抑制整个RAAS功能,降低血浆AngⅡ和醛固酮水平,同时抑制交感神经活性,降低外周阻力,产生降压作用。第一代肾素抑制药由于生物利用度低、易为蛋白酶水解等缺点,临床应用价值低。
阿利吉仑(alikiren)是非肽类肾素抑制药,为第二代肾素抑制药。通过抑制肾素,降低肾素活性,防止血管紧张素原转化成Ang I,在第一环节阻断RAAS.减少AngⅡ和醛甾酮的生成,不引起血浆肾素活性代偿性升高。
醛固酮受体阻断药
醛固酮可引起血管顺应性下降、心血管重构、内皮功能紊乱和儿茶酚胺释放,对高血压的发生发展起促进作用。螺内酯(spironolactone)为传统的醛固酮受体阻断药,可阻断醛固酮受体复合物形成,抑制水钠潴留,降低血压。同时,其还可阻断雄激素受体和孕激素受体,引起男性乳房女性化以及其他性激素相关的不良反应。
依普利酮(eplerenone)为选择性醛固酮受体阻断药,可阻止醛固酮与盐皮质激素受体结合,从而抑制醛固酮对血管及靶器官的作用,降低血压。用于各型高血压,尤其适用于并发心功能不全或心肌梗死的高血压患者。常见不良反应有高钾血症和血肌酐水平增高。
-
钙通道阻滞药
钙通道阻滞药(calcium channel blockers,CCB)通过阻滞L型电压门控性钙通道,降低心肌细胞和血管平滑肌细胞内的Ca2+浓度,导致心输出量减少;使血管平滑肌对缩血管物质的反应性降低,血管扩张,外周血管阻力下降,发挥降压作用。 钙通道阻滞药的优点为:收缩压下降较明显,适用于老年高血压患者;适用于合并外周血管疾病的高血压患者;有抗动脉粥样硬化作用,降压同时不影响血脂、血糖代谢;保护靶器官。缺点是可引起反射性交感活性增强。

硝苯地平(nifedipine)阻滞L型钙通道,通过抑制细胞外Ca2+内流,使细胞内Ca2+浓度降低,主要使小动脉扩张,外周阻力下降,血压下降。但外周血管的扩张可以反射性的兴奋交感神经,使心率加快。对轻、中、重度高血压都有效,多用于合并心绞痛、肾疾病、糖尿病、哮喘、高脂血症及恶性高血压患者。

尼群地平(nitrendipine)血管松弛作用较硝苯地平强,降压作用温和而持久,适用于各型高血压。拉西地平(lacidipine)血管选择性强,降压作用起效慢,持续时间长,不易引起反射性心动过速和心输出量增加,用于治疗轻、中度高血压,且具有抗动脉粥样硬化作用。氨氯地平(amlodipine)降压作用较硝苯地平温和,t1/2可达40~50h,维持时间较硝苯地平显著延长。可以选择性地作用于血管,在扩张血管的同时,不影响心脏的传导和收缩力。
-
肾上腺素受体阻断药
交感神经在血压的调节中起重要作用,其效应是通过α、β肾上腺素受体所介导。
β受体阻断药
β受体阻断药广泛用于高血压的治疗,能有效地降低血压。长期应用一般不引起水钠潴留,也没有明显的耐受性。β受体阻断药可通过多种机制发挥其降压作用。
普萘洛尔(propranolol)降压作用温和、持久、不易产生耐受性。其降压作用可能为:
- 阻断心肌细胞β1受体,使心率减慢,心肌收缩力减弱,心输出量减少,血压减低;
- 阻断中枢β受体,通过改变中枢的降压调节机制产生降压作用;
- 阻断外周去甲肾上腺素能神经末梢突触前膜的β2受体,抑制其正反馈作用,使交感神经末梢释放去甲肾上腺素减少,降低外周交感神经的活性;
- 抑制肾小球入球动脉的β1受体,减少肾素的释放,阻断 RAAS,发挥降压作用;
- 增加前列环素的合成。用于各种程度的原发性高血压,特别是对年轻患者、心输出量及肾素活性偏高者疗效较好。对伴有心肌梗死、心绞痛、焦虑症的患者疗效尤佳。
α受体阻断药
特拉唑嗪(terazosin)选择性阻断α1受体,降低外周血管阻力,使血压下降,降压作用持续时间长。
哌唑嗪(prazosin)选择性阻断α1受体,舒张小动脉和静脉,降低外周血管阻力,使血压下降。其优点是对代谢没有明显的不良影响,并显著降低血浆三酰甘油和低密度脂蛋白,同时升高高密度脂蛋白。对突触前膜α2受体无明显作用,故不引起反射性心动过速及肾素分泌增加等作用。用于轻、中度高血压。能降低心脏的前、后负荷,亦用于治疗心功能不全。
α和β受体阻断药
拉贝洛尔(labetalol)为非选择性β受体阻断药,兼有α1受体阻滞作用。适用于治疗轻度至重度高血压和心绞痛,静脉注射治疗高血压危象。
卡维地洛(carvedilol)为α和β受体阻断药,用于治疗轻、中度高血压或伴有肾功能不全、糖尿病的高血压患者。
中枢性降压药
中枢性降压药主要作用于延髓背侧孤束核(NTS)α2肾上腺素受体和延髓嘴端腹外侧区(RVLM)的咪唑咻I1受体,发挥降压作用。
可乐定(clonidine)降压作用中等,不影响肾血流量和肾小球滤过率。可抑制胃肠分泌及胃肠活动。其降压机制为:

- 作用于延髓嘴端腹外侧区的咪唑咻I1受体,降低交感神经张力,使外周血管阻力下降,产生降压作用;
- 兴奋延髓背侧孤束核突触后膜的α2受体,抑制中枢交感神经冲动的传出,使外周血管扩张,血压下降;
- 兴奋去甲肾上腺素能神经末梢突触前膜α2受体,减少去甲肾上腺素的释放。适用于中度高血压,特别适用于合并胃溃疡的高血压患者。不影响肾血流量和肾小球滤过率,适用于肾性高血压。
莫索尼定(moxonidine)为第二代中枢性降压药,对I1咪唑啉受体的选择性比可乐定高。用于治疗轻、中度高血压,长期用药能逆转心肌肥厚。
神经节阻断药
曾广泛用于高血压的治疗,但因不良反应严重,降压作用过强过快,现已少用,仅短期用于一些特殊情况,如高血压危象、主动脉夹层动脉瘤、外科手术中的控制性降压等。药物有美卡拉明(mecamylamine)、樟磺咪芬(trimetaphan camsilate)。

去甲肾上腺素能神经末梢阻滞药

去甲肾上腺素能神经末梢阻滞药主要影响儿茶酚胺的贮存和释放,从而影响交感神经对血管的作用,产生降压,现已少用。药物有利血平(reserpine)、胍乙啶(guanethidine)等。
-
血管扩张药
血管扩张药通过直接扩张血管,发挥降压作用。降压的缺点在于降压时可反射性引起交感神经兴奋、肾素-血管紧张素系统激活,从而引起心率加快、心肌耗氧量增加和体液潴留,削弱药物的降压效应,并存在诱发心绞痛的风险。因此该类药物目前一般不单独用于高血压,主要在其他一线抗高血压无效时,与利尿药、β受体阻断药合用增强其疗效并抵消其副作用。

肼屈嗪(hydralazine)直接舒张小动脉,降低外周血管阻力而降压。其舒张小动脉平滑肌的机制可能是通过促进血管内皮细胞一氧化氮(NO)生成,增加细胞内cGMP浓度以及血管平滑肌细胞的超极化,降低细胞内Ca2+水平而发挥作用。对静脉血管无明显作用。
硝普钠(sodium nitroprusside)在血管平滑肌内代谢为一氧化氮(NO),后者具有强大的舒张血管平滑肌的作用。可扩张小动脉和小静脉,使容量血管扩张,回心血量减少,血压降低。可反射性的兴奋交感神经。用于高血压危象,也可用于急、慢性心功能不全。
钾通道开放药

钾通道开放药可以促进钾通道开放,使钾离子外流增加,细胞膜超极化,膜兴奋性减少,钙离子内流减少,血管平滑肌舒张,进而使血压下降。在降压的同时,伴有反射性的心动过速和心输出量增加。一般不单独用于降血压。代表药物有米诺地尔(minoxidil)、吡那地尔(pinacidil)、尼可地尔(nicorandil)等。
常见的手术造模有两肾一夹和腹主动脉缩窄等,这两种手术都是通过使肾血流量下降激活RAAS系统,使血管收缩,造成肾血管性高血压。但同时应注意手术也会造成肾损伤。
两肾一夹模型
麻醉大鼠,仔细分离肾动脉,在肾动脉自主动脉分叉处放置标准钢丝(直径0. 2mm),使用银夹钳夹闭银夹,然后取出标准钢丝,逐层关闭肌肉、皮肤。具有造模简单,成功率高,同一性强等优点,与人类高血压病理过程具有可比性,是最常用的经典高血压动物模型。

肾血管性高血压模型制备方法示意图
腹主动脉缩窄模型
在实验动物左右肾动脉上方(约0.5cm或根据需要)小心分离腹主动脉,将7号针头(直径约0.3mm,或根据需要选择其他直径针头)穿线后平行放置于分离后的腹主动脉并结扎,然后抽出钢针,致使腹主动脉狭窄,从而建立腹主动脉缩窄性高血压大鼠模型。该模型可以造成负荷增高型大鼠心室肥厚和心衰,适用于高血压的心血管损伤相关研究。
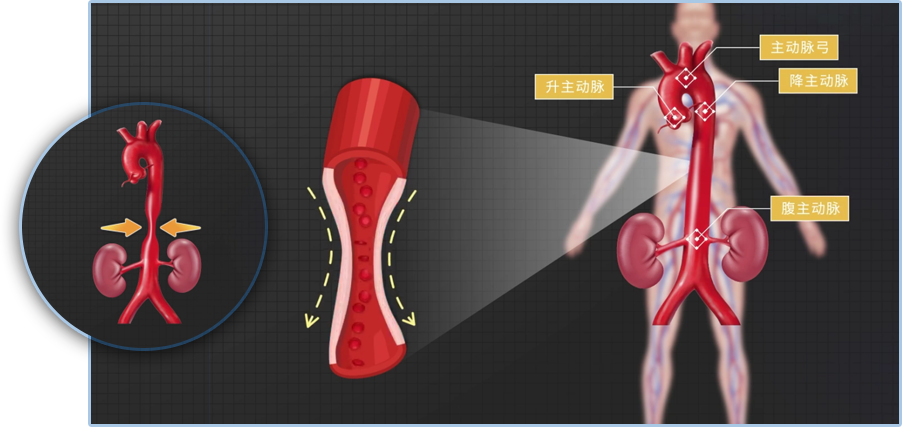
腹主动脉缩窄模型示意图
常见的遗传性高血压动物模型有SHR、DSS鼠、FHH鼠、米兰高血压鼠、遗传性压力诱导高血压鼠等。是通过从普通大鼠如Wistar或SD大鼠中选育血压偏高的部分一代一代培养而成。其中最常使用的是SHR,即自发性高血压大鼠。
SHR大鼠自发性高血压发病率高,约为100%。在4~6周龄期间,在无任何应激刺激(物理、药物、手术等因素)下,自发形成高血压,这些环境因素影响高血压的程度,因此,对温度、声、光等饲养环境要求严格。5周龄的SHR大鼠血压可达150mmHg,成年后血压可达180~200mmHg,甚至可达200mmHg以上。

SHR大鼠选育代数与血压关系
直接高盐饮食诱导
在制备高血压模型时,NaCl常被用作高血压形成的促进因素。选取健康成年大鼠(220-250g),给予高盐饮食饲料 (含8% NaCl) 和/或饮用0.85% NaCl溶液。6-8周左右即可观察到模型组血压升高。该模型操作简单,成功率高,易复制,可用于盐敏感性高血压的研究及抗高血压药物的筛选。

高盐饮食诱导大鼠高血压模型示意图
去氧皮质酮(DOC)盐性高血压模型
成年大鼠常规麻醉后作腹部正中切口,切除左肾。术后大鼠皮下注射溶于橄榄油的醋酸去氧皮质酮(DOC)50mg/kg体重,每周给药5天,共5周,同时饮1%NaCl溶液代替饮水。给药1周后血压开始升高,5周后70%大鼠形成持久高血压。DOC盐性高血压模型制备简便,高血压较稳定,且对降压药物的反应与高血压患者比较相符。

去氧皮质酮(DOC)盐性高血压模型制备方法
许多高血压成因与单基因突变或功能丧失有关,采用基因工程技术可以很好地模拟这类高血压疾病对生理机能的改变。例如APOL1基因的多态性与高血压肾病有关,sFlt-1与子痫发病有关。此外,直接使用基因工程改变血压调节通路中的重要组成分子也可以造成高血压。例如过表达肾素基因可以激活肾素-血管紧张素系统,使血压升高。
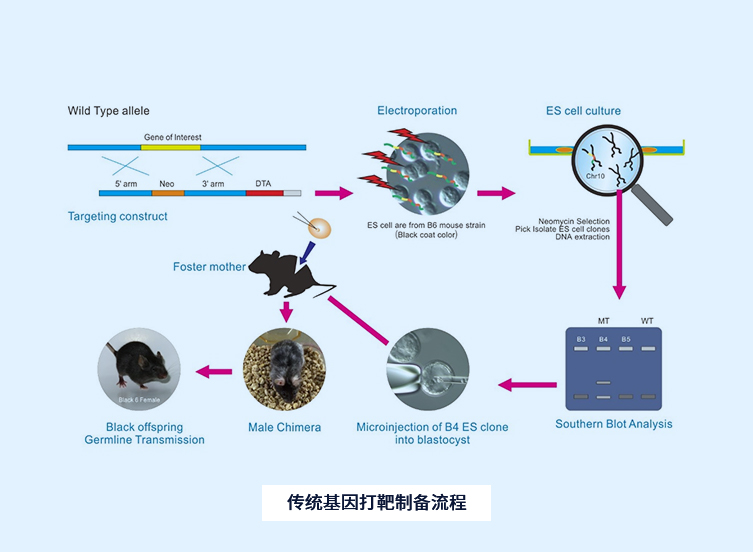
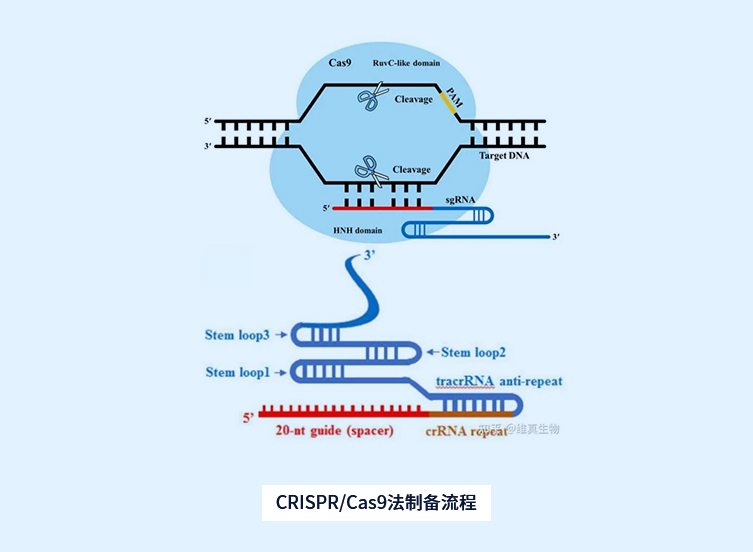
转基因大鼠(transgenic rat, TGR)模型
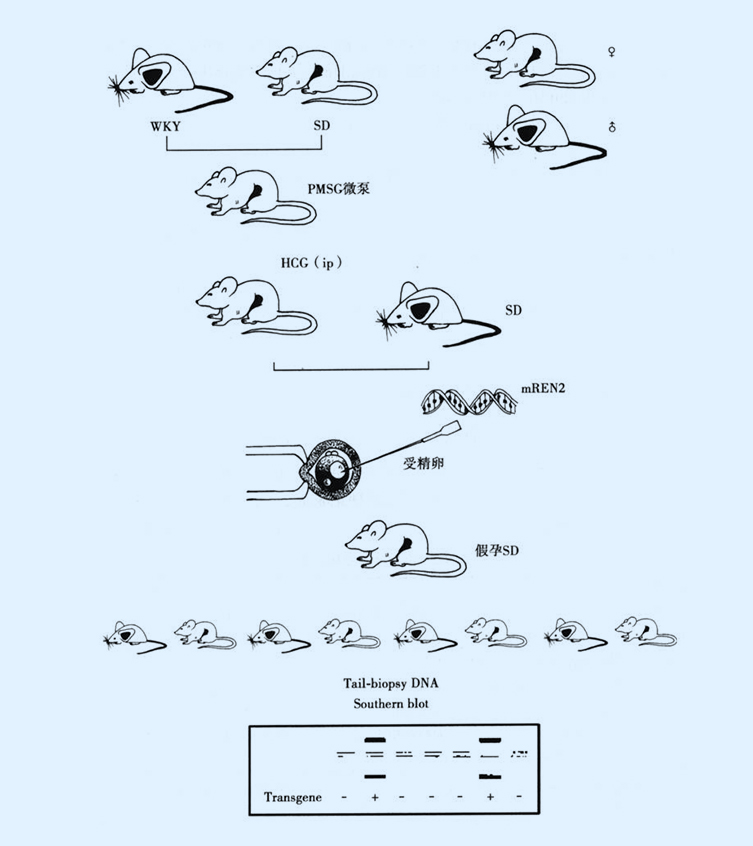
TGR(mREN2)27制备流程
基因敲除鼠模型